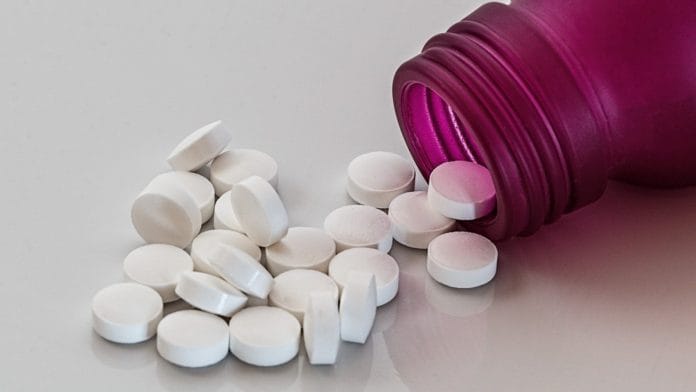
नई दिल्ली: मुंबई स्थित दवा निर्माता लूपिन फार्मास्यूटिकल्स कैंसर पैदा करने वाले पदार्थ की उपस्थिति के कारण अमेरिकी बाजार से अपनी एंटी डायबिटिक दवा मेटफॉर्मिन हाइड्रोक्लोराइड के संस्करण को खुद वापस ले रही है.
यूएस फूड एंड ड्रग एडमिनिस्ट्रेशन (एफडीए) ने गुरुवार को इसकी घोषणा की और कहा कि इसके विश्लेषण से पता चला है कि 500 मिलीग्राम की विस्तारित-रिलीज़ टैबलेट ‘अशुद्ध एन-नाइट्रोसोडिमिथाइलैमाइन (एनडीएमए)’ के लिए स्वीकार्य दैनिक सेवन की सीमा को पार कर गया है.
दवा के विस्तारित-रिलीज़ संस्करण को तैयार किया जाता है ताकि यह समय के साथ धीरे-धीरे शरीर में रिलीज़ हो. इसका लाभ यह है कि एक रोगी को कम बार गोलियां लेने की आवश्यकता होगी. इसका मतलब यह भी है कि कम दुष्प्रभाव हो सकते हैं, क्योंकि शरीर में दवा का स्तर अधिक सुचारु रूप से होगा है.
एफडीए ने बयान में कहा, ‘अभी तक ल्यूपिन फार्मास्यूटिकल्स इंक को इसके आने से संबंधित प्रतिकूल घटनाओं की कोई रिपोर्ट नहीं मिली है.’
एनडीएमए को प्रयोगशाला परीक्षणों के परिणामों के आधार पर एक संभावित मानव कार्सिनोजेन के रूप में वर्गीकृत किया जाता है- एक पदार्थ जो कैंसर का कारण बन सकता है. एनडीएमए एक ज्ञात पर्यावरणीय संदूषक है और कम मात्रा में यह मीट डेयरी उत्पादों और सब्जियों सहित पानी और खाद्य पदार्थों में पाया जाता है.
एक मौखिक दवा मेटफॉर्मिन हाइड्रोक्लोराइड टाइप 2 मधुमेह के साथ वयस्कों में रक्त शुगर नियंत्रण में सुधार करने के लिए सबसे अच्छी दवाओं में से एक है. यह यकृत में ग्लूकोज उत्पादन को कम करता है, आंतों से शुगर (ग्लूकोज) के अवशोषण में देरी करता है और इंसुलिन के लिए शरीर की संवेदनशीलता को बढ़ाने का काम करता है.
एफडीए ने कहा, ‘अमेरिका में दवा के शीर्ष निर्माताओं में से एक ‘ल्यूपिन अपने थोक विक्रेताओं, वितरकों और मेल ऑर्डर फ़ार्मेसियों को फोन द्वारा अधिसूचना के माध्यम से सूचित कर रहा है और सभी प्रोडक्ट वापस लाने की व्यवस्था कर रहा है.’
पहली बार नहीं
28 मई को यूएस एफडीए ने घोषणा की थी कि एजेंसी प्रयोगशाला परीक्षण ने एनडीएमए के स्तरों को मेटफार्मिन के कई विस्तारित-रिलीज़ (ईआर) फॉर्मूलेशन में एजेंसी की स्वीकार्य सेवन सीमा से ऊपर बताया था.
उन्होंने पहले कहा था, ‘एजेंसी पांच कंपनियों के साथ संपर्क में है, ताकि वे स्वेच्छा से अपने उत्पादों को वापस लाने सिफारिश कर सकें… जो मेटफार्मिन ईआर फॉर्मूलेशन के अतिरिक्त निर्माता हैं और अमेरिकी बाजार के एक महत्वपूर्ण हिस्से की आपूर्ति करते हैं और उनके उत्पादों को वापस नहीं लाया जा रहा है.’
एफडीए उचित परीक्षण सुनिश्चित करने के लिए निर्माताओं के साथ मिलकर काम करना जारी रखे हुए है. यह निर्धारित करने के लिए मूल्यांकन चल रहा है कि क्या मेटफॉर्मिन ईआर वापस लाने में कमी होगी और एजेंसी किसी भी कमी को रोकने या कम करने के लिए निर्माताओं के साथ मिलकर काम करेगी.
भारत निगरानी अपडेट को बारीकी से देखता है
भारत, जिसे दुनिया की मधुमेह राजधानी के रूप में जाना जाता है, में लगभग 7.3 करोड़ मधुमेह रोगी हैं. चिंताओं को देखते हुए, कई डॉक्टरों ने विस्तारित रिलीज़ टैबलेट की प्रिस्क्रिप्शन बंद कर दिया था.
दिल्ली स्थित फोर्टिस सेंटर ऑफ एक्सीलेंस फॉर डायबिटीज, मेटाबॉलिक डिजीज एंड एंडोक्रिनोलॉजी के चेयरमैन डॉ अनूप मिश्रा ने कहा, ‘ईआर मेटफॉर्मिन में कैंसरकारी अशुद्धियों को देखते हुए हमने इस दवा को देना बंद कर दिया है. ‘दूसरी ओर हम सादे मेटफॉर्मिन का उपयोग करना जारी रखेंगे क्योंकि यह मधुमेह के लिए सबसे अच्छी दवा है.’
भारतीय दवा नियामक सेंट्रल ड्रग स्टैंडर्ड कंट्रोल ऑर्गनाइजेशन (सीडीएससीओ), यूएस एफडीए अपडेट की भी निगरानी कर रहा है.
एक वरिष्ठ अधिकारी ने कहा, ‘जबकि हमने भारतीय उत्पादों के साथ कोई चिंता नहीं की है, हम यूएस एफडीए अपडेट की बारीकी से निगरानी कर रहे हैं.’
(इस खबर को अंग्रेजी में पढ़ने के लिए यहां क्लिक करें)